突破性纳米药物载体研发背后,这两项检测技术竟成 “关键推手”
发布时间:2025-10-14分享至:
在生物医药领域,“精准递送” 一直是攻克疾病的核心难题 —— 如何让药物避开生理屏障、直达病灶并精准释放,是科研人员不懈探索的方向。近日,《ACS Omega》期刊发表的一项研究给出了新答案:基于 β- 环糊精的交联纳米颗粒(CD-CO NPs),凭借优异的生物相容性、pH 响应降解性和高载药能力,成为极具潜力的新型药物递送载体。而这一成果的落地,离不开纳米粒度分析(DLS) 与zeta 电位分析技术的全程支撑。
一、药物载体的 “黄金标准”:为什么粒径和表面电荷是关键?
理想的纳米药物载体,需要同时满足 “稳定循环”“高效靶向”“安全降解” 三大要求,而这两点特性直接决定其性能:
• 粒径大小:若粒径过大(>400nm),易被人体免疫系统清除,无法穿透肿瘤组织间隙;若过小(<50nm),则可能提前渗透到非靶组织,增加毒副作用。
• 表面电荷:合适的表面电荷能避免载体团聚(如负电荷可减少与带负电细胞膜的非特异性吸附),同时影响细胞摄取效率 —— 这正是 zeta 电位的核心检测价值。
此次研究中,科研团队通过纳米粒度与 zeta 电位测试,将 CD-CO NPs 的性能 “精准调控” 到理想范围,最终实现药物的高效递送。
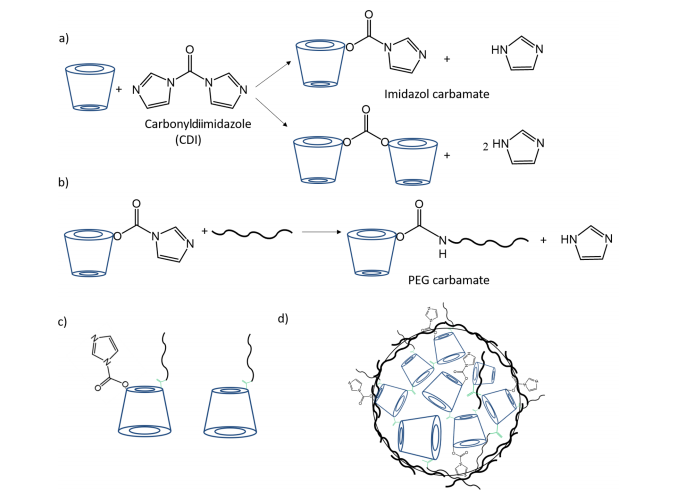
图1.(a)β-环糊精(CD)游离羟基的环糊精偶联反应(CDI)及(b)咪唑氨基甲酸酯中间体与甲氧基聚乙二醇胺的反应示意图。图(c)展示了β-环糊精与氨基-PEG可能发生反应的示意图,(d)为最终形成的环糊精-氨基甲酸酯纳米颗粒(CD-CO NPs)结构。
二、DLS 技术:从 “无序合成” 到 “精准控径” 的核心工具
传统环糊精纳米载体的制备,常面临 “粒径不均”“需机械破碎” 的问题(如部分纳米海绵粒径>400nm),导致其难以满足体内递送需求。而本研究通过动态光散射(DLS) 技术,实现了从 “试错合成” 到 “精准调控” 的突破:
1. 实时监测,锁定最佳合成比例
科研团队以 β- 环糊精(β-CD)和碳二亚胺(CDI)为原料,测试了 1:6~1:18 的不同原料配比。通过 DLS 实时检测 aqueous suspension 中纳米颗粒的 hydrodynamic diameter(水合粒径),发现当 β-CD:CDI=1:12 时,颗粒粒径分布最窄(PDI 低至 0.255),水合粒径稳定在 200-300nm—— 这一尺寸既能避免被肾脏过快滤过,又能穿透肿瘤组织的 “增强渗透滞留效应(EPR)”,为后续药物递送奠定基础。
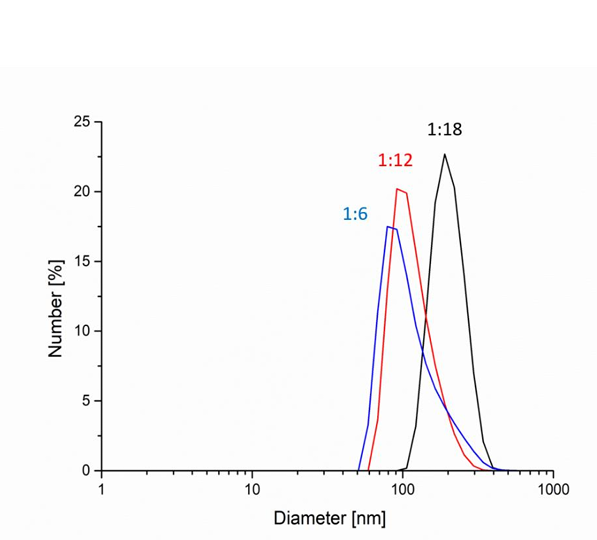
图2:未聚乙二醇化环糊精-环糊精内酯(CD-CO)纳米颗粒在水中的动态光散射(DLS)测量结果(左图):不同环糊精摩尔比的样品:1:6(蓝色)、1:12(红色)和1:18(黑色)。
2. 长期追踪,验证胶体稳定性
纳米载体的 “长期稳定性” 是其产业化的关键 —— 若在储存或体内循环中发生团聚,将直接失效。研究团队通过 DLS 对 CD-CO NPs 进行了长达 1 个月的追踪:在中性水溶液(pH=7)中,颗粒水合粒径始终维持在 200-300nm,无明显变化;即便在细胞培养基(DMEM)或缓冲液(PBS)中,仍保持良好分散性。这一结果通过 DLS 的 “强度 / 数量加权分布” 双重验证,为其后续体内应用提供了可靠数据支撑。
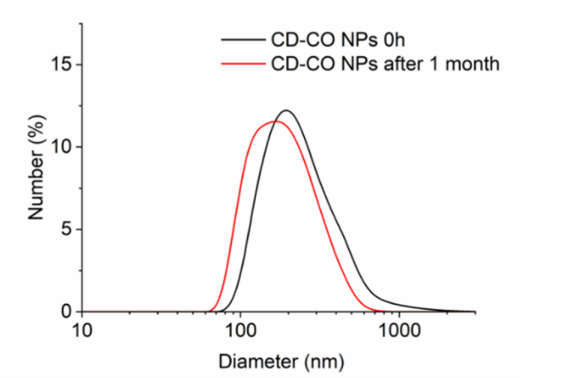
图3.粒径介于100-160纳米之间的CD-CO纳米颗粒的DLS测量显示(流体动力学)粒径分布峰值在200-300纳米,且在水中可保持数月的胶体稳定性
三、zeta 电位分析:破解 “载体团聚” 难题的关键
纳米颗粒的团聚问题,是制约其应用的 “老大难”—— 传统未修饰的环糊精纳米颗粒,在水溶液中几分钟内就会絮凝。而本研究通过zeta 电位分析,找到了解决方案:
1. 揭示表面电荷与稳定性的关联
研究团队通过 zeta 电位检测发现,PEG 修饰后的 CD-CO NPs 在 pH=7.3 时,表面电荷为 - 14mV。这一弱负电位源于 β- 环糊精分子暴露的羟基 —— 负电荷间的排斥作用,有效抑制了颗粒间的团聚,使其在水溶液中稳定分散数周。反观未 PEG 修饰的颗粒,因表面电荷杂乱,zeta 电位无稳定峰值,最终快速絮凝。
2. 预判体内行为,降低毒副作用
zeta 电位不仅影响胶体稳定性,还与载体的 “体内清除” 密切相关:过度负电或正电的颗粒,易被血液中的蛋白吸附(形成 “蛋白冠”),进而被巨噬细胞清除;而 - 14mV 的弱负电位,既能避免非特异性吸附,又能减少与红细胞、内皮细胞的相互作用,延长体内循环时间 —— 这正是 zeta 电位技术对 “载体安全性” 的重要预判价值。
四、总结:检测技术是纳米生物医药研发的 “基石”
从 CD-CO NPs 的合成优化、稳定性验证,到功能实现,纳米粒度(DLS) 与zeta 电位分析始终扮演着 “眼睛” 的角色:
• 对研发端:它们帮助科研人员快速筛选最佳合成条件,避免 “盲目试错”,加速成果落地;
• 对应用端:它们为载体的 “体内安全性”“有效性” 提供量化数据,降低产业化风险;
• 对行业端:它们推动纳米药物从 “概念” 走向 “实用”,为精准医疗提供技术支撑。
DS100纳米粒度及ZETA电位分析仪,由贝拓科学自主研发。它采用动态光散射技术,可精准测量纳米颗粒的粒径分布与ZETA电位,并具备精确温控功能,满足不同条件下的测试需求。

DS100纳米粒度仪 贝拓科学
未来,随着纳米药物向 “更精准、更高效” 方向发展,纳米粒度与 zeta 电位技术将发挥更重要的作用 —— 它们不仅是检测工具,更是生物医药创新的 “关键推手”。
(注:本文数据及成果均来自《ACS Omega》2025 年发表的 “Cross-Linked Cyclodextrin-Based Nanoparticles as Drug Delivery Vehicles: Synthesis Strategy and Degradation Studies” 一文,感兴趣的读者可查阅原文深入了解。)
Wehl, L.; Muggli, K.; Möller, K.; Engelke, H.; Bein, T. Cross-Linked Cyclodextrin-Based Nanoparticles as Drug Delivery Vehicles: Synthesis Strategy and Degradation Studies. ACS Omega 2025, *10* (12), 10352–10365.
下一篇:无